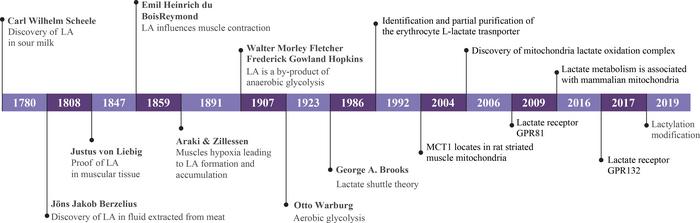
Eine bahnbrechende Studie, veröffentlicht am 9. Juni 2025 in der Zeitschrift Frontiers of Medicine, zeigt, dass Milchsäure (Laktat) weit mehr als ein Nebenprodukt des Stoffwechsels ist: Sie spielt eine zentrale Rolle in der Tumor-Immun-Kommunikation und beeinflusst die Wirksamkeit von Krebstherapien. Forscher zeichnen die historische Entwicklung von Laktat – von seiner Entdeckung 1780 bis zur Erkenntnis 2019, dass es Histone modifiziert – nach und beleuchten seine vielfältigen Funktionen im Tumormikromilieu (TME).
Laktat, das durch hohen glykolytischen Fluss in Tumoren entsteht, wird zusammen mit Protonen über den Monocarboxylattransporter 4 (MCT4) ausgeschieden, wodurch das extrazelluläre Milieu angesäuert wird. Dieser saure pH-Wert baut die extrazelluläre Matrix ab, behindert die Aufnahme von Medikamenten und neutralisiert Chemotherapeutika. Gleichzeitig nutzen Krebszellen Laktat als Energiequelle, fördern DNA-Reparaturmechanismen und verstärken durch Signalwege wie GPR81 die Expression von PD-L1, was die Immunabwehr schwächt.
Die Studie zeigt, dass Laktat verschiedene Immunzellen unterschiedlich beeinflusst. Tumorassoziierte Makrophagen werden zu einem metastasenfördernden Phänotyp umprogrammiert, dendritische Zellen verlieren ihre Fähigkeit zur Antigenpräsentation, und natürliche Killerzellen werden durch intrazelluläre Ansäuerung geschwächt. Regulatorische T-Zellen hingegen werden durch Laktat gestärkt, während CD8+-T-Zellen durch Stoffwechselstörungen und eingeschränkte Infiltration geschädigt werden. Paradoxerweise kann Laktat in bestimmten Kontexten die Stammzellenprogramme von CD8+-T-Zellen fördern, was auf komplexe immunmodulierende Effekte hinweist. Auch Stromazellen wie Krebsassoziierte Fibroblasten und Endothelzellen verstärken durch Laktat-getriebene Mechanismen die Immunsuppression und fördern Tumorwachstum sowie Angiogenese.
Die Forscher schlagen drei therapeutische Strategien vor, um diese Effekte zu bekämpfen. Erstens, die Reduktion der Laktatproduktion durch Hemmung der Glykolyse mit Wirkstoffen wie 2-Desoxyglucose oder MCT-Blockern wie Syrosingopin, was zu einer metabolischen Krise in Tumorzellen führt. Zweitens, die Kombination mit Immuntherapien, etwa durch Pufferung des TME mit Bikarbonat oder durch Hemmung von Laktat-assoziierten Enzymen, um die Wirksamkeit von Anti-PD-1-Therapien zu steigern. Drittens, die Umleitung von Laktat in die Mitochondrien von Immunzellen, etwa durch Lithiumcarbonat, um deren Antitumor-Aktivität wiederherzustellen. Innovative Ansätze wie Laktat abbauende Nanosysteme zeigen in präklinischen Modellen vielversprechende Ergebnisse, indem sie Immunzellen reaktivieren und Tumore bekämpfen.
Trotz des Potenzials bleiben Herausforderungen: Die Toxizität von Laktathemmern in normalem Gewebe, die heterogene Stoffwechselabhängigkeit von Tumoren und die Notwendigkeit präziser Dosierungen erfordern weitere Forschung. Zukünftige Entwicklungen wie laktatresponsive Nanocarrier und die Kartierung von Laktatwegen auf Einzelzellebene könnten die Krebsimmuntherapie revolutionieren, indem sie Laktat von einem Hindernis zu einem therapeutischen Ansatzpunkt machen.

Credits:
Jingwei Ma1, , Liang Tang2, , Jingxuan Xiao1, , Ke Tang3, , Huafeng Zhang4, , Bo Huang2,3